|
Эванса Оксазолидоны в асимметрическом альдоле (Evans Oxazolidinones) спасибки Thomas Ball |
|
Оксазлидоны Эванса нашли широчайшее применение в качестве вспомогательных реагентов в синтезе карбоновых килот и их производных. Оксазолидоны обычно получают из легкодоступных аминокислот, таких как валин или фенилаланин. |
|
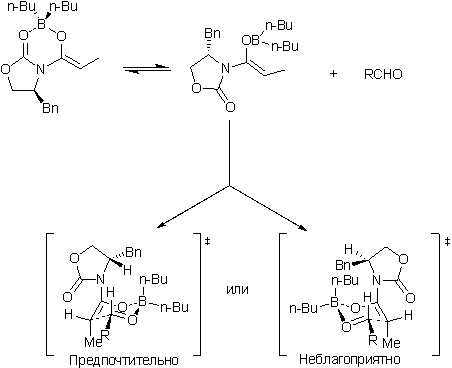
Общая схема и механизм
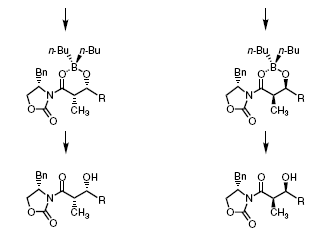
-В реакции образуется почти исключительно Z-енолят - Контролирующие селективность группы располагают реакционную плоскость енолята так (Chiral controller group biases enolate p-faces) , что переходное состояние ведущее к син- изомеру намного более предпочтительно. - Диполь-дипольные взаимодействия в имиде минимальны в реакционноспособной конформации. (смотри: Noe, E. A.; Raban, M J. Am. Chem. Soc. 1975, 97, 5811-5820). - Разнообразные хиральные имиды могут быть использованы для асимметрической альдольной конденсации. - Анти-продукты образуются в количествах менее 1% - Обычно одна кристаллизация позволяет получить диастереомерночистый продукт.
Пример реакции
Пример методики: |
|
Ссылки 1. Первая публикация: D. A. Evans, J. Bartroli, T. L. Shih J. Am. Chem. Soc. 1981, 103, 2127-2129. 2. Обзоры: E. M. Carreira, A. Fettes, C. Marti, Organic Reactions 2006, 67, 1-216. (b) Y. Gnas, F. Glorius Synthesis, 2006, (12), 1899-1930.(c) T. D. Machajewski, C.-H. Wong, R. A. Lerner, Angewandte Chemie, International Edition 2000, 39(8), 1352-1374. 3. Механизм: 4. Evans, D.A et al.;
J.Am.Chem.Soc; 1988; 110; 2506 |
|
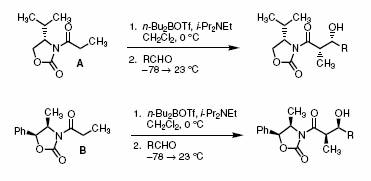
Современные примеры использования оксазолидонов Эванса в асимметрической альдольной конденсации: |
|
Примечание: Эта реакция еще один пример использования оксазолидонов Эванса в альдольной конденсации. При использованиии этих реагентов альдольная конденсация происходит почти исключительно как син-процесс. Механизм включает образование преимущественно z-енолятов. Реакция обычно приводит к продукту с диастереомерным избытком выше 99%. Ссылки: Armstrong, A. et al; Tetrahedron, 2003, 59(3):367-375. |
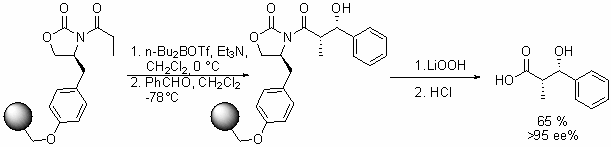
|
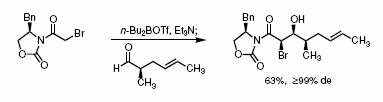
Примечание: Этот пример очень похож на предыдущий, присоединение также происходит с противоположной от заместителя стороны. Гидролизом продукта при помощи гидропероксида лития была получена карбоновая кислота. Ссылки: Phoon, C.W.; Abell, C,; Tetrahedron Letters; 1998, 39(17), 2655-2658. |