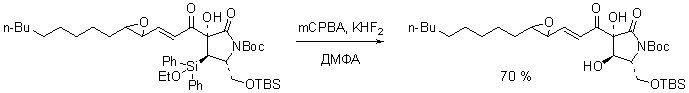|
Реакция Флеминга-Тамао (Fleming-Tamao-Kumada Oxidation) спасибки мне |
|
|
Окисление силильных групп до гидроксильных было одновременно открыто в группах Флемминга и Тамао. Окисление диметилфенилсилильной группы и специфический механизм превращения были исследованы Флемингом с сотрудниками. Реакция Флеминга-Тамао является удобным методом превращения, инертных ко многим реакциям, кремнийорганических соединений в спирты. |
|
|
Схема и механизм:
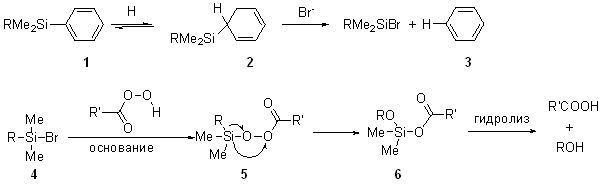
Флемминга окисление Тамао окисление Результатом окисления по Тамао-Флеммингу в обеих модификациях является спирт с той же конфигурацией что и у исходного силана т.е. рекация происходит с сохранением конфигурации. В случае модификации Флеминга, реакция проиходит в две стадии. На первой стадии происходит замещение фенильной группы на галоген, в классическом варианте это бром. Получающийся в условиях реакции, силилбромид 4 реагирует с перкислотами или перекисью водорода образуя ацилпероксиды 5. Они в свою очередь перегруппировываются в алкоксисиланы 6, которые после гидролиза и дают спирты.
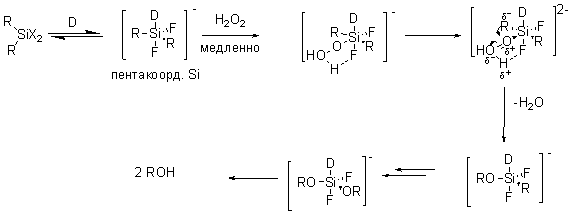
В случае модификации Тамао исходным могут быть производные силифторидов, алкоксисиланов и т.д. (X = OR, NR2, F, Cl). Существует немного подверждений предложенному механизму, тем не менее он является принятым для данной реакции. Предполагается что силан координирует с нуклеофилами (D = F- или донорный растворитель (например ТГФ, ДМФ).) образуя комплекс пентакоординированого кремния. Этот комплекс более электофилен чем исходный силан и может реагировать с пероксидом водорода образуя интермедиат с шестикоординированный кремнием. Дальнейшая миграция радикала с кремния на кислород и элиминирование воды ведет к алкоксисилану, который после гидролиза и дает спирт. |
|
|
Общая методика. Organic Syntheses, Coll. Vol. 9, p.539 (1998); Vol. 73, p.94 (1996). link (Тамао окисление) Окисление диметилфенилсиланов в спирты, общая методика (Флеминга окисление): Science of Synthesis 2001, 4, 413-425. KBr (0.14 г, 1.18 ммоль) и безводный NaOAc (0.25 г) были прибавлены к раствору диметилфенилсилана (0.98 ммоль) в ледяной уксусной кислоте (2.5 мл) при перемешивании. К получившейся смеси добавляют по каплям AcOOH (2.5 мл) при охлаждении на ледянной бане. Дополнительно к смеси добавляют NaOAc (0.75 g) и AcOOH (7.5 мл), а получающийся мутный раствор перемешивают 18 часов при комнатной температуре и 1 час при 35 °C. Затем к смеси добавили Et2O (100 мл) и порошок NaHSO3 (10 г) , после чего перемешивают 0.5 часа, профильтровали через Целит (Celite), и упарили в вакууме. Остаток растворили в эфире, промыли нас. р-ром NaHCO3, NaCl, высушили над Na2SO4 и упарили при пониженном давлении. Продукт был выделен после колоночной хроматографии.. |
|
|
Ссылки: 1. Первая публикация: 2) K. Tamao, N. Ishida, M. Kumada, Journal of Organic Chemistry 1983, 48, 2120. (b) I. Fleming, R. Henning, H. Plaut, Chemical Communications 1984, 29-31. 2. Обзоры: (a) K. Tamao, Yoshida, J.-I.; Itami, K. Product subclass 18: silyl peroxides. Science of Synthesis 2001, 4, 413-425. (b) G. R. Jones, Y. Landais Tetrahedron, 52, 22, 1996, 7599-7662. link 3. Механизм: |
|
|
Использование Флеминга-Тамао реакции в современной литературе: |
|
|
Примечания: Синтез праманицина, высокоэффективного антибиотика против возбудителей менингита. Ссылки: A. G. M. Barrett; J. Head, M. L. Smith, N. S. Stock, A. J. P. White, A. J. P.; Williams, D. J. Journal of Organic Chemistry 1999, 64(16), 6005-6018. |
|
|
Примечания: Ссылки: |
|
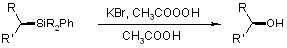 и
и 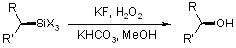
 X = F.
X = F.