Реакция Хека (Mizoroki-Heck Reaction)
возм.синонимы: Мизороки-Хека реакция
![]()
R= алкенил, арил, аллил, алкинил, бензил;
Х= галогенид, трифлат
R'= алкил, алкенил, COOR,OR, SiR3
Наиболее "хорошими" субстратами для реакции Хека являются замещенные электронакцепторными группами алкены: акрилаты и т.д.
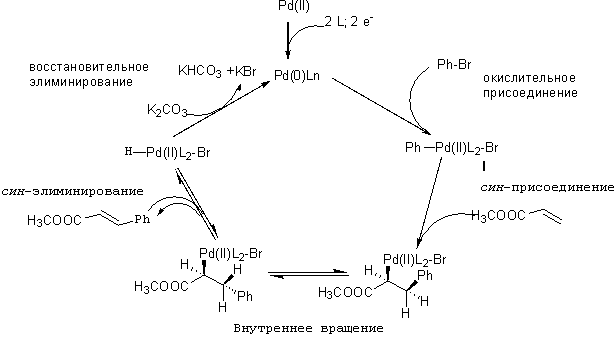
Общая схема и механизм:

Механизм реакции Хека на примере взаимодействия фенилбромида с метил акрилатом. Каталитический цикл реакции схож с похожими реакциями кросссочетаний (Сузуки).
Каталитический цмкл начинается с окислительного присоединения фенил бромида к
Примеры:
• Замыкание пяти, шести- и семичленных циклов (наиболеее эффективное) приводит преимущественно к экзо- продуктам.

Hong, C. Y.; Kado, N.; Overman, L. E. J. Am. Chem. Soc. 1993, 115, 11028–11029.
Пример методики:
Organic Syntheses, Vol. 81, p.63 (2005). ссылкаЛитература:
Первая публикация: (a) Mizoroki, T.; Mori, K.; Ozaki, A. Bull. Chem. Soc. Jpn. 1971, 44, 581. (b) Heck, R. F.; Nolley, J. P., Jr. J. Org. Chem. 1972, 37, 2320.
Механизм: (a) R. F. Heck, Acc. Chem. Res., 1979, 12, 146; (b) J. P. Knowles, A. Whiting, Organic & Biomolecular Chemistry 2007, 5(1), 31-44.
Обзоры:
• Общие:
(а) R. F. Heck, Organic Reactions, 1982, 27, 345. (б) Brase, S.; de Meijere, A. In Metal-catalyzed Cross-coupling Reactions, Diederich, F., and Stang, P. J., Eds.; Wiley-VCH: New York, 1998, pp. 99–166. (в) Cabri, W.; Candiani, I. Acc. Chem. Res. 1995, 28, 2–7. (г) de Meijere, A.; Meyer, F. E. Angew. Chem., Int. Ed. Engl. 1994, 33, 2379–2411.
• Внутримолекулярный:
(а) Link, J. T.; Overman, L. E. In Metal-catalyzed Cross-coupling Reactions, Diederich, F., and Eds.; Wiley-VCH: New York, 1998, pp. 231–269. (б) Gibson, S. E.; Middleton, R. J. Contemp. Org. Synth. 1996, 3, 447–471. (в) Link, J. T. Organic Reactions 2002, 60, 157-534.
• Асимметрический:
Shibasaki, M.; Boden, C. D. J.; Kojima, A. Tetrahedron 1997, 53, 7371–7393.
Реакция Хека в современной литературе:
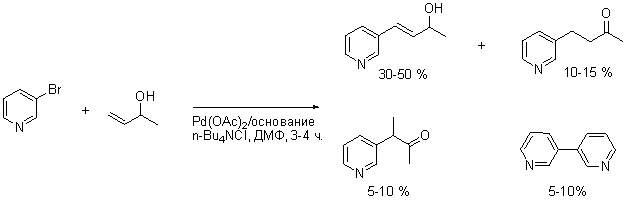
Примечания: При проведении реакции Хека в присутствии n-Bu4NCl и основания была получена смесь продуктов. Хорошая иллюстрация возможных побочных реакций: мигрирования двойной связи и кросс-сочетаний.
Ссылки: Yum, E. K.; Kang, S. K.; Choi, J.-K. Bull. Korean Chem. Soc. 2001, 22, 6, 644-646. link
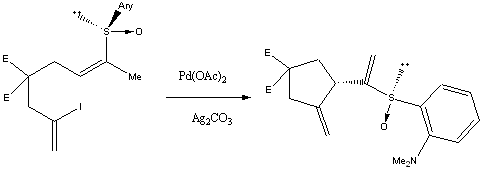
Примечания: В данном примере были исследована возможность проведения асимметрической реакции Хека. В статье описаны синтез и поведение разнообразных иодоалкенил-сульфоксидов в условиях внутримолекулярного Хека. 2-(N,N-диметиламино)фенилсульфинильная группа оказалась наиболее эффективной для проведения внутримолекулярного асимметрической реакции Хека 2-йод-1,6-(или 1,7)диенов. Последующие удаление сульфоксидной вспомогательной группы позволило получить циклопентаны (циклогексаны) с хорошей энантиомерной чистотой.
Ссылки: Buezo, N. D.; Mancheno, O. G.; Carretero, J. C. Org. Lett., 2000, 2 (10), 1451 -1454