|
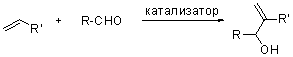
Реакция Бэйлиса-Хиллмана-Морита (Baylis-Hillman-Morita reaction) возм. синонимы: Байлиса-Хиллмана, Бэйлиса-Гилмана, МБХ реакция. спасибки Цыганеку и Скверу. |
|
|
Взаимодействие альдегидов с непредельными соединениями в присутствии третичных фосфинов было описано японским химиком Морита с соавторами в 1967 году. Пятью годами позже два американца: Энтони Бэйлис и Мельдорн Хиллман опубликовали классическую вариацию реакции с третичным амином (ДАБЦО) в качестве катализатора. Реакция позволяет получать аллиловые спирты из альдегидов и некоторых кетонов взаимодействием с активированными олефинами. |
|
|
Схема и механизм:
R = H, Алкил, Арил. R' = PhSO2, C(O)R'', CN, COOR''. катализатор = ДАБЦО, трибутилфосфин, трициклогексилфосфин. Нуклеофилы (олефины) располагаются в следующий ряд по реакционной способности: фенил винилсульфонат > α , β -ненасыщенные кетоны > акрилонитрил > акрилаты ~ этил винилфосфонат > фенил винил сульфон ~акриламиды. Акриламиды подвергаются МБХ реакции только в очень жестких условиях. Обычно реакцию проводят без растворителя. Часто побочной реакией является ди- и олиго-мериризация олефина. В случае легко енолизирумых кетонов получаются также продукты альдольной конденсации и присоединения по Михаэлю.
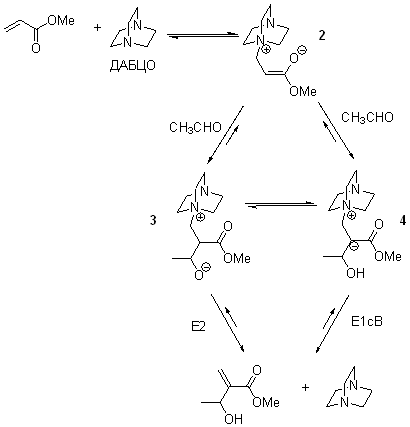
Механизм реакции предполагает обратимое присоединение амина (фосфина) по двойной связи с образованием цвиттериона 2. Цвиттерион 2 реагирует с альдегидами образуя цвиттерион 3. Под воздействием оснований этот цвиттерион претерпевает анти-Е2-элиминирование. Продукт получается в результате последующего протонирования. Альтернативный путь реакции, предполагает внутренний перенос протона с образованием цвиттериона 4, который претерпевает Е1сВ элиминирование, ведущее к продуктам реакции. Оба пути реакции могут реализоваться в зависимости от растворителя и давления. |
|
|
Общая методика: Organic Syntheses, Coll. Vol. 8, p.420 (1993); Vol. 68, p.64 (1990). link Organic Syntheses, Coll. Vol. 10, p.41 (2004); Vol. 75, p.106 (1998). Procedure A. link |
|
|
Ссылки: 1. Первая публикация: (a) Baylis, A. B.; Hillman, M. E. D. Ger. Offen. 2,155,113 (1972); Chem. Abstr. 1972, 77, 34174q; Hillman, M. E. D.; Baylis, A. B. U.S. Patent 3,743,669 (1973). (b) K. Morita, Z. Suzuki, H. Hirose,Bull. Chem. Soc. Jpn. 1968, 41, 2815. 2. Обзоры: (a) Y.-L. Shi, M. Shi, European Journal of Organic Chemistry 2007, (18), 2905-2916. (b) G. Masson, C. Housseman, J. Zhu, Angewandte Chemie, International Edition 2007, 46(25), 4614-4628.(c) D. Basavaiah, A. J. Rao, T. Satyanarayana Chemical Reviews 2003, 103(3), 811-891. (d) D. Basavaiah, P. D. Rao, R. S. Hyma, Tetrahedron, 52 (24), 1996 , 8001-8062. (e) E. Ciganek, K. Square, Organic Reactions 51, 111-213. 3. Механизм: (a) J. S. Hill, N. S. Isaacs,J. Phys. Org. Chem. 1990, 3, 285. (b) Y. Fort, M. C. Berthe, P. Caubère, Tetrahedron 1992, 48, 6371. |
|
|
Использование Бэйлиса-Хиллмана-Морита в современной литературе: |
|
|
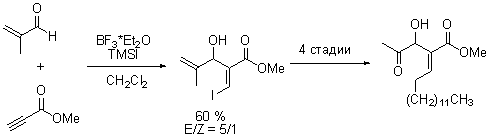
Примечания: Синтез секокотомолида А был осуществлен посредством современной вариациии реакциии Б-Х-М. В присутствие трифторида бора и триметилсили йодида в качестве источника йода возможно Е-селективное присоединение альдегида и йода по тройной связи. Ссылки: S. I. Lee, G.-S. Hwang, S. C. Shin, T. G. Lee, R. H. Jo, D. H. Ryu, Org. Lett.; 2007; ASAP; DOI: 10.1021/ol702134w |
|
|
Примечания: Ссылки: |
|