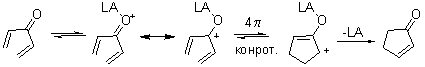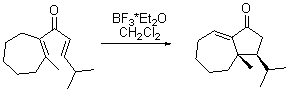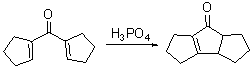|
Назарова Реакция (Nazarov reaction) спасибки мне и |
| Циклизация дивинилкетонов в замещенные циклопентеноны, называют реакцию открытою И. Н. Назаровым в 1941. Она может быть использована для синтеза соединений с азуленовой, стероидной или терпеновой структурой. Нахождение новых катализаторов, позволяющих проводить реакцию в мягких условиях, вызвало бум исследований этой реакции в последние годы. |
|
Схема и механизм:
LA = H+ (H2SO4, HCl), AlCl3, FeCl3, BF3 и т.д. Растворители: CH2Cl2 Заместители определяют конечное положение двойной связи. Классическая реакция Назарова это стереоселективная конротаторная электроциклизация циклопентадиенильного катиона, который получается взаимодействием дивинилкетонов с кислотами Льюиса (протоном в классическом случае). Побочные продукты - 2-гидроксициклопентаноны, тетра-гидро-2-пираноны и в-ва, образующиеся в результате миграции кратной связи в цикле.Пример реакции: Циклизация происходит с образованием кетона с экзоциклической двойной связью. |
|
Общая методика: . цис-Трицикло[6.3.0.03,7]ундец-1(8)-ен-2-он (Циклизация Дивинил Кетона)
1,1¢-Циклопентенил кетон (19 г, 0.12 моль) был прибавлен при быстром перемешивании в атмосфере азота к горячей (100°) фосфорной кислоте (100 г). Бесцветный раствор незамедлительно потемнел и стал коричневым.Реакционную смесь перемешивали еще полчаса при 100°. Далее реакционный сосуд был помещен в ледяную баню и 100 г льда было добавлено немедленно к еще горячей кислоте. Смесь перемешивали еще пять минут. Темный осадок образовавшийся при добавлении льда растворили в диэтиловом эфире. Смесь экстрагировали диэтиловаым эфиром, высушили над MgSO4 и экстракт упарили. Трициклический продукт 11.9 г (62%) был получен в виде бесцветной жидкости медленной перегонкой коричневого масло (19 г) при пониженном давлении. 95% isomeric purity by gas chromatography (OV-225) Ткип 60–63° (0.05 torr); UV nm max ( ε ) 244 (3700), 308 (72); IR (Nujol) 1690, 1630 cm–1; 1H NMR ( CDCl3, 270 MHz) δ мультиплеты: 3.2 (1H), 3.1 (1H), 2.5 (2H), 2.4 (4H), 1.9 (1H), 1.6 (4H), 1.3 (1H). Тпл 2,4-динитрофенилгидразона 201–202° (хлороформ/этанол). K. L. Habermas, S. E. Denmark, T. K. Jones, Org. React. 1994, 45, 1–158. |
|
Ссылки: 1. Назаров И. Н., "Успехи химии", 1951, т. 20, в. 1, с. 71-103. 2) Обзоры: Harmata, M. Chemtracts 2004, 17, 416. (b) Tius, M. A. Eur. J. Org. Chem. 2005, 11, 2193. (c) Frontier, A. J.; Collison, C. Tetrahedron 2005, 61, 7577. 3) механизм: D. N. Kursanov, Z. N. Parness, I. I. Zaretskaya, and I. N. Nazarov, Izv. Akad. Nauk SSSR, Ser. Khim., 1954, 859 [C.A., 49, 13910a (1955)].; I. N. Nazarov and I. I. Zaretskaya, J. Gen. Chem. USSR, 27, 693 (1957). |
|
Использование Реакции Назарова в современной литературе: |
|
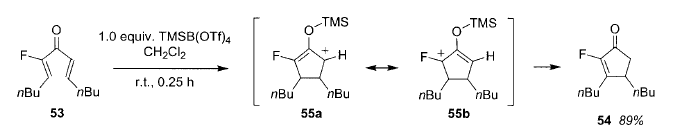
Примечания: Абсолютно региоселективная завершающая стадия реакции наблюдается при потере протона в присутствии заместителя-фтора. Хорошо известная способность атомов фтора стабилизировать катион на близлежащем атоме углерода делает структуру 55b более предпочтительной чем 55a. Потеря протона ведет к енону 54. Ссылки: J. Ichikawa, Pure Appl. Chem. 2000, 72, 1685–1689. |
|
Примечания: Ссылки: |