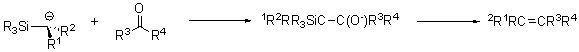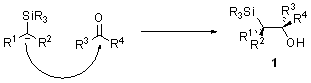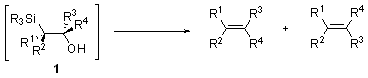|
Петерсона Реакция (Peterson Olefination) спасибки мне |
|
|
Присоединение стабилизированных триорганилсилильнойгруппой α-карбоанионов к карбонильным соединениям с последующим стереоселективным элиминированием под воздействием кислоты или основания с образованием алкена называют олефинированием по Петерсону. α-Силилкарбанионы могут быть получены из соответствующих α-галогенсиланов по реакции Гриньяра, их металлированием, депротонированием силанов сильными основаниями или присоединением металлорганических соединений к винилсиланам. Разнообразные ароматические, алифатические и непредельные альдегиды и кетоны вступают в эту реакцию. |
|
|
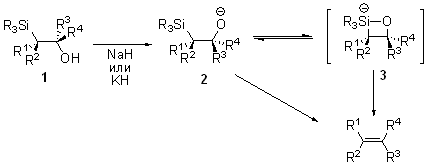
Схема и механизм:
В реакцию вступает широкий спектр карбонильных соединений (R3, R4 = H, Alk, Ar и т.д.). Основный ограничением данной реакции является возможность получения α-силилкарбанионов.
Механизм реакции Петерсона зависит от характера заместителей (R1,R2) в α-силилкарбанионе. Первой стадией во всех случаях является нуклеофильное присоединение силилкарбаниона по карбонильной группе с образованием β-гидроксисилана 1.
В случае электронакцепторных (R1 или R2 = C(O)R, COOR) и арильных заместителей в α-силилкарбанионе, образующийся β-гидроксисилан 1 неустойчив, происходит спонтанное элиминирование силанола ведущее к алкенам. Стереоселективность реакции Петерсона в таком случае как правило не зависит от температуры и среды. Природа вступающих в реакцию α-карбоаниона и карбонильного соединения влияют на соотношение образующихся изомеров олефина.
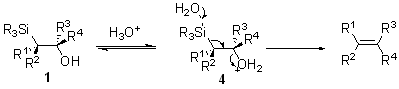
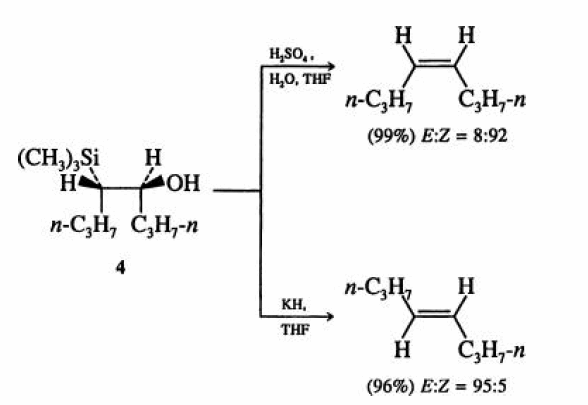
В случае электрондонорных заместителей (R1 или R2 = алкил, H, NR2) в α-силилкарбанионе стереоселективность реакции Петерсона зависит от среды. В кислой среде элиминирование гидроки- и триалкилсилильнойгрупп происходит из наиболее термодинамически выгодной анти-перипланарной конформации О-протонированной формы β-гидроксисилана 4.
Противоположная геометрия продукта, получающаяся путем син-элиминирования силанола из промежуточного силоксетана 3, наблюдается в присутствии оснований (NaH, KH).
Возможность контроля геометрии продуктов является одним из крупных достоинств данной реакции.
|
|
|
Пример методики: Organic Syntheses, Coll. Vol. 9, p.580 (1998); Vol. 73, p.50
(1996). ссылка Organic Syntheses, Coll. Vol. 8, p.602 (1993); Vol. 69, p.89 (1990).
ссылка |
|
|
Ссылки: 1. Первая публикация: D.J.Peterson, J. Org. Chem., 1968, 33, 780. 2. Обзоры: L. F. van Staden, D. Gravestock, D. J. Ager; Chem. Soc. Rev., 2002, 31(3), 195 - 200. (б) N. Kano, T. Kawashima, Modern Carbonyl Olefination 2004, 18-103. (в) В. Н. Коротченко, В. Г. Ненайденко, Е. С. Баленкова, А. В. Шастин, Успехи Химии, 2004, 73(10), 1039-1074. (d) D. J. Ager, Organic Reactions, Vol. 38., 162-301. 3. M. B. Gillies, J. E. Tnder, D. Tanner, P. Norrby, J. Org. Chem., 67 (21), 7378 -7388, 2002. |
|
|
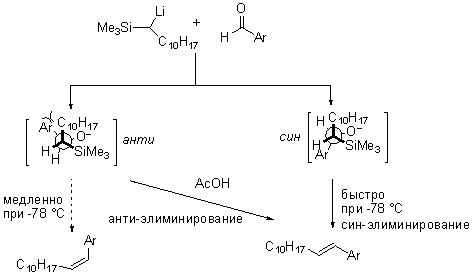
Примеры Реакции Петерсона в современной литературе: |
|
|
Примечания: Стереоспецифичное олефинирование по Петерсону из смеси диастереомерных бета-силилалкоксидов. Ссылки: "J. B. Perales, N. F. Makino, and D. L. Van Vranken, J. Org. Chem., 67 (19), 6711 -6717, 2002 |
|
|
Примечания: Ссылки: |
|