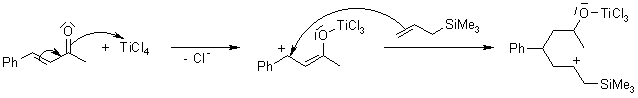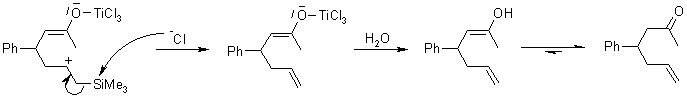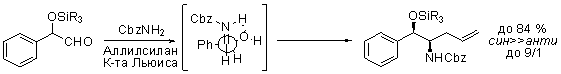|
Сакураи Реакция (Hosomi-Sakurai Reaction) (возможные синонимы: Хосоми-Сакурая реакция, Сакурая реакция) спасибки мне и |
|
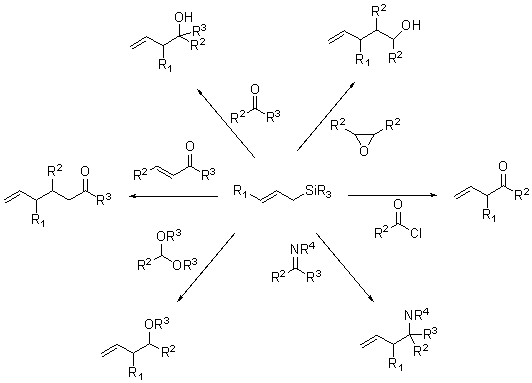
Аллилирование всевозможных электрофилов с помощью аллилсиланов в присутствии кислот Льюиса называют реакцией Сакураи. Открытая Хосоми и Сакураи как 1,4-присоединение триметилсилана к непредельным карбонильным соединениям, на сегодняшний день реакция включает в себя такие субстраты как: альдегиды, кетоны, ацетали, имины, эпоксиды и ацил хлориды. Кислота Льюиса необходима для эффективного аллилирования. |
|
Схема и механизм:
R = CH3, Alk Кислоты Льюиса = TiCl4, AlCl3, TMSOTf.. Растворители: ТГФ. Под реакцией Хосоми-Сакураи подразумевают довольно широкий спектр реакций аллилсиланов с разнообразными электрофилами, катализирумый кислотами Льюиса. К-та Льюиса может быть использована в каталитических количествах. Похожая реакция, катализируемая фторид ионами, как правило так не называется.
Принятый механизм реакции сакураи пердполагает активацию электрофильного агента кислотой Льюиса, образующийся комплекс реагирует c аллилсиланом. Интермедиат содержит карбакатион, стабилизированный кремнием в β-положении. (β эффект) Последующее элиминирование кремния ведет к продукту аллилирования. |
|
Общая методика: Organic Syntheses, Coll. Vol. 7, p.443 (1990); Vol. 62, p.86 (1984). ссылка |
|
Ссылки: 1) Первая публикация: A. Hosomi, H. Sakurai, Tetrahedron Letters 1976, 1295-1298. 2) Обзоры: Fleming, I. et al. Org. React. 1989, 37, 57-575. (б) D. Schinzer, Synthesis 1988; 1988: 263-273 (в) A. Hosomi, K. Miura, Bulletin of the Chemical Society of Japan 2004, 77(5), 835-851. 3) Механизм: (а) Fleming, I. et al. Org. React. 1989, 37, 57-575. (б) A. Schweig, U. Weidner, and G. Manuel, J. Organomet. Chem. 1974, 67, C4. |
|
Использование Реакции Сакурая в современной литературе: |
|
Примечания: Трехкомпонентная аза-Сакураи реакция с O-защищенными (±)-миндальными альдегидами дала син-гидрокси гомоаллиламины 2 и 2d в качестве основных продуктов с необычно высокой селективностью. Внутримолекулярная хелатизация с помощью водородной связи в переходном состоянии объясняет высокую 1,2-син диастереоселективность. Ссылки: J.-R. Ella-Menye, W. Dobbs, M. Billet, P. Klotz, A. Mann, Tetrahedron Letters, 2005, 46(11), 1897-1900. |
|
Примечания: Ссылки: |