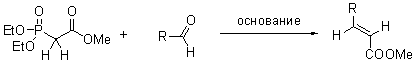|
Реакция Хорнера-Вадсворта-Эммонса (Hoerner-Wadsworth-Emmons reaction) (возм. синонимы: Уэдсворта-Хорнера-Эммонса, Хорнера-Эммонса-Уодсворда, Виттига-Хорнера, Вэдсворта-Эммонса) спасибки мне |
|
|
Реакция, открытая в группе Хорнера и разработанная группой Эммонса в начале шестидесятых, получила большую популярность в последние годы. Под реакцией ХВЭ понимают получение олефинов взаимод. карбонильных соединений (альдегидов, некоторых кетонов) с диалкиловыми эфирами алкилфосфоновых к-т в присут. сильных оснований. Реакция позволяет получить замещенные транс-акриловые кислоты с высокой селективностью. Достоинством данной реакции является возможность использовать высокостабильные и легкодоступные соединения пятивалентного фосфора. Карбанионы, получаемые из фосфонатов, более нуклеофильны и реакционноспособны, чем фосфорные илиды использумые в реакции Виттига. Диалкилфосфонаты, получающиеся в реакции в качестве побочных продуктов, легко удаляются при водной обработке. |
|
|
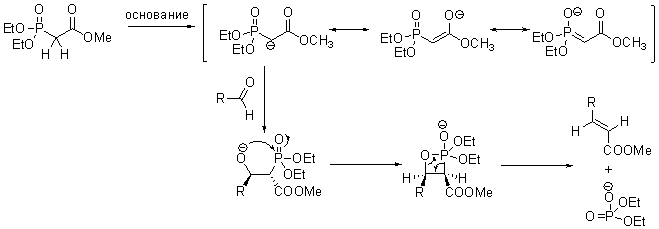
Схема и механизм:
основания = BuLi, NaH, терт-BuOK, DBU c LiCl, NaNH2. растворители = ТГФ, бензол, ацетонитрил, 1,2-диметоксиэтан (ДМЭ). E-стереоселективность сильно варьируется в зависимости от условий реакции и увеличивается в следующих рядах:
Механизм реакции изучен не достаточно хорошо. Считается что включает в себя стадии: генерации аниона из фосфоната, присоединения его к карбонильному соединению, последующая циклизация интермедиата в фосфетан и заключительное элиминирование диаклилфосфоната ведущее к алкену (аналогичное с реакцией Виттига).
см. также реакция Стилл-Геннари |
|
|
Показательные Методики. Приготовление реагентов: Organic Syntheses, Coll. Vol. 8, p.192 (1993); Vol. 66, p.194 (1988). link Organic Syntheses, Coll. Vol. 10, p.289 (2004); Vol. 78, p.169 (2002). link Проведение олефинирования: Organic Syntheses, Coll. Vol. 10, p.66 (2004); Vol. 78, p.177 (2002). link Organic Syntheses, Coll. Vol. 9, p.39 (1998); Vol. 74, p.1 (1997). link Organic Syntheses, Coll. Vol. 5, p.547 (1973); Vol. 45, p.44 (1965). link |
|
|
Ссылки: 1. Первая публикация: (a) Horner, L.; Hoffmann, H. M. R.; Wippel, H. G. Chem. Ber. 1958, 91, 61-63 (b) Wadsworth, W. S., Jr.; Emmons, W. D. J. Am. Chem. Soc. 1961, 83, 1733. 2. Обзоры: (a) Boutagy, J.; Thomas, R. Chem. Rev. 1974, 74, 87-99 (b) Maryanoff, B. E.; Reitz, A. B. Chem. Rev. 1989, 89, 863-927. (с) W. S. Wadsworth Organic Reactions, v. 25, 1977, 73-253; 3. Механизм: K. Ando, J. Org. Chem. 1999, 64, 6815-6821; (b) P. Brandt, P.-O. Norrby, I. Martin, T. Rein, J. Org. Chem. 1998, 63, 1280-1289. |
|
|
Использование реакции Хорнера-Вадсворта-Эммонса в современной литературе: |
|
|
Примечания: Total Synthesis and Revision of C6 Stereochemistry of (+)-Amphidinolide W. Ссылки: A. K. Ghosh, G. Gong, Journal of Organic Chemistry 2006, 71(3), 1085-1093 |
|
|
Примечания: Внутримолекулярная реакция Хорнера-Виттига была использована при синтезе (+)-brefeldin A на заключающих стадиях. Лучший выход в 74 % был достигнут при использовании LiCl с iPr2NEt в ацетонитриле. Стереоселективность была относительно низкой E:Z = 1.4:1 Ссылки:
S.-Y. Seo, J.-K. Jung, S.-M. Paek, Y.-S. Lee, S.-H. Kim, Y.-G. Suh, Tetrahedron Letters 2006, 47(37),
6527-6530. |
|