Асимметрическое дигидроксилирование по Шарплессу (Sharpless Asymmetric Dihydroxylation (AD))
спасибки David Klauber (Jesus)
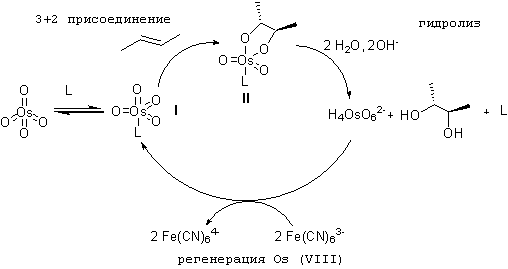
Схема и механизм:
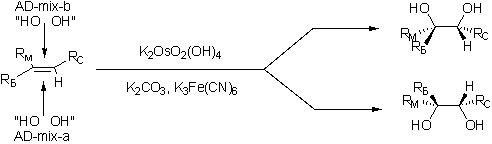
Где RБ-больший заместитель при двойной связи;
Rм-меньший заместитель
Rс- средний по размеру заместитель
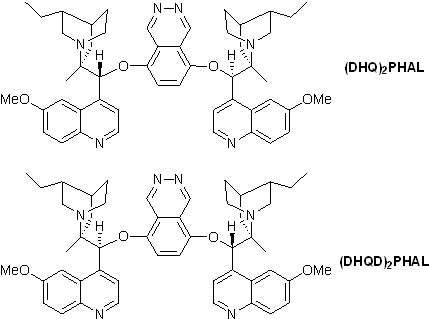
1 кг "AD-mix alpha" содержит следующие ингредиенты: (DHQ)2PHAL (5.52g), K3Fe(CN)6 (700 g), K2CO3 (294 g), и K2OsO4·2H2O.(0.52 g)
- Низкая скорость реакции тризамещенных алкенов обусловлена низкой скоростью гидролиза интермедиата (гликолята осмия.)
- Гидролиз может быть значительно ускорен (до 50 раз) добавлением метилсульфонамида.
- Реакцию обычно проводят в смеси tert-BuOH/вода 1:1 при 0oC.
Пример реакции:
Данный пример из оригинальной работы Хентгеса (Hentges) и Шарплесса (Sharpless) по асимметрической индукции в дигидроксилировании с тетрокисью осмия. Относительная низкая стереоселективность и эквимолярные количества аминов обьясняются тем, что это одна из первых работ в этой области, до того как каталитический процесс был разработан, а е.е. оптимизированы. В ней были использованы в мономерные хининовые лиганды DHQD-OAc и DHQ-OAc, в последствии оказавшиеся менее эффективными. Несколько олефинов было использовано в качестве лигандов , но лучшие результаты достигнуты с (E)-стильбеном.
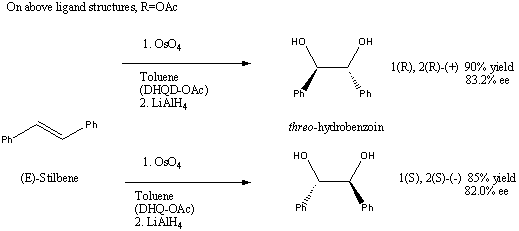
K. B. Sharpless J. Org. Chem. 1992, 57, 2768
Пример методики:
Organic Syntheses, Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). ссылка
Organic Syntheses, Coll. Vol. 9, p.383 (1998); Vol. 70, p.47 (1992). ссылкаReferences
1. Первая публикация: Hentges, S. G.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 4263
2. Механизм: Wai, J. S. M.; Markó, I.; Svendsen, J. S.; Finn, M. G.; Jacobsen, E. N.; Sharpless, K. B. J. Am. Chem. Soc. 1989, 111, 1123.
3. Обзоры: (a) A. B. Zaitsev, H. Adolfsson, Synthesis 2006, (11), 1725-1756. (b) M. C. Noe, M. A. Letavic, S. L. Snow, Organic Reactions 2005, 66, 109-625 (с) Kolb, H. C.; VanNieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483-2547.
Асимметрическое эпоксидирование по Шарплессу в современной литературе:
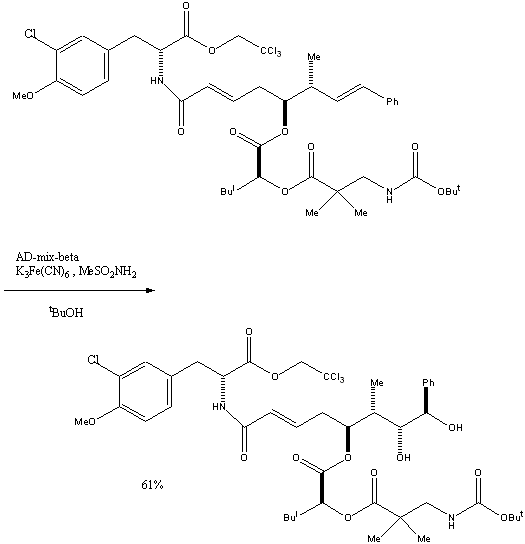
Примечания: В данном примере гидроксилирование было ключевой стадией в синтезе Криптофицинов, цитотоксичных макролидных диспептидов выделяемых сине-зелеными водрослями и проявляющих противораковую активность. Желаемый криптофицин был синтезирован с помощью дигидроксилирования по Шарплессу. Содержащаяся в нем эпоксидная группа не может быть получена при прямом асимм. эпоксидировании с хорошей стереоселективностью. Дигидроксилирование же протикает высоко-стереоселективно и полученный хиральный диол был превращен в соответствующий эпоксид через ряд трансформаций, оптимизированных для получения высокого выхода в присутствии групп чувствительных к основаниям.
Reference: Liang, Jian;Moher, Eric D.;Moore, Richard E.;Hoard, David W. J. Org. Chem. 2000, 65(10), 3143-3147;
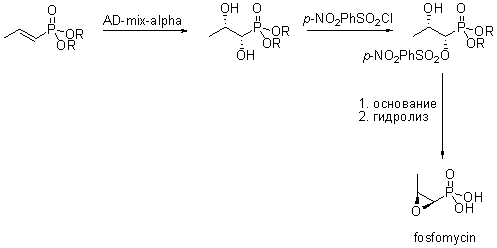
Примечания: Фосфомицин (Fosfomycin) является природной органической фосфорной кислотой, а также производным фосфодецина. (fosfadecin.) Оба природных соединения проявляют бактерецидную активность против Грам- положительных и Грам- отрицательных бактерий. В данном примере, эпоксид был синтезирован из хирального диола, полученного с помощью дигилроксилирования по Шарплессу, что позволило избежать разделения рацемата. Наилучшим субстратом для асимметрического дигидроксилирования оказался бензиловый эфир (R=Bn) и модифицированная " AD-mix-alpha" смесь ( в смеси были использованы в 3 раза большие количества K2OsO4·2H2O (AD-mix-alpha(x3)) в качестве реагента. Это позволило достичь хорошего выхода и e.e.
Reference: Kobayashi, Yuichi; William, Anthony D.; Tokoro, Yuko J. Org. Chem. 2001, 66(23), 7903-7906